Начальник Управления Минздрава Людмила Реутская просит не паниковать. Хотя признает: сложности на пути к единому рынку есть. Но носят они, скорее, профессиональный характер. Идет работа над соглашением, где указаны общие для всех правила и принципы обращения таблеток да микстур. Документ должен быть подписан до конца нынешнего года. Следующий шаг — разработка около трех десятков более детальных нормативных актов и сводов. Например, как будут работать фарминспекторы и проводиться проверка.
Дело в том, что наши специалисты контролируют лекарства от процесса создания до утилизации. В мире действуют иначе: делают своеобразные контрольные закупки уже на рынке. Но пока есть опасность, что к нам могут попасть, скажем, некачественные антибиотики (даже крупные мировые производители, бывает, отзывают свою продукцию из-за «ошибки»), отказываться от своей практики в Минздраве не собираются. Тем более что она дает плоды. Так, в этом году эксперты уже 85 раз забраковали лекарства. Одни в действительности по виду или назначению не соответствовали описанию в инструкции, в других оказалось меньше нужных действующих веществ и т.д. К слову, нашим подходом уже заинтересовались коллеги из стран-партнеров.

— Но человека надо хорошо обучить, прежде чем внести его в создаваемый единый реестр инспекторов Таможенного союза. Потому что потом его вердикту будут доверять все. И на каждом предприятии должна быть создана система обеспечения качества, когда оно встроено во все процессы абсолютно. У заводов наших это понимание есть. И сертификаты на основные производственные участки есть, — перечисляет Людмила Реутская.
Кстати, о сертификатах. Единый фармрынок предполагает, что все производства будут соответствовать весьма строгому стандарту качества GMP, который требуется для поставок в Евросоюз. Одно из условий, например, — помещения с особым режимом фильтрации воздуха и входными шлюзами. Впрочем, невозможное становится возможным после модернизации отдельных производств и «оживления» инвестпроектов — как по Указу № 174, так и по собственному желанию. Однако, перед тем как получить сертификат и отправлять лекарства в Европу, нужно зарегистрировать препарат за рубежом, принять аудиторскую инспекцию из этой страны. Успеть всем 28 фармпредприятиям нужно до конца следующего года, подчеркивают в Минздраве.

Пока же две трети экспорта приходится на страны СНГ. Востребованы наши лекарства также в странах Юго-Восточной Азии, Латинской Америки, Африки. В списке потенциальных рынков сбыта значатся Венесуэла и Куба.
А что внутренний рынок? Здесь зарегистрировано 6 тысяч лекарственных средств, из них более 1,3 тысячи — собственного производства. Если измерять упаковками, то, по данным Минздрава за 2013 год, это 134,6 миллиона - 57,7 % объема рынка в натуральном выражении.
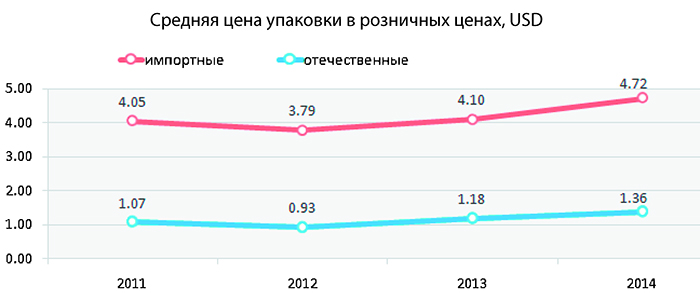
Правда, в аптеках покупатели по-прежнему чаще всего выбирают импортное средство, которое на слуху, хоть и дороже отечественного аналога. Производители признаются: на маркетинг не всегда хватает средств и времени. Что и отражается на финансовых показателях. Между тем на создание инновационного препарата, где применены научные разработки и новейшие технологии, от идеи до выпуска в свет уходит от 500 тысяч долларов. И, как минимум, несколько лет, а то и целое десятилетие. Гораздо проще и дешевле выпускать так называемые джинерики — воспроизведенные лекарственные средства, аналогичные патентованным оригинальным. Тоже импортозамещение. Таким образом, ежегодно в стране по соответствующей программе осваивается более сотни новых лекарств. В большинстве своем стоят они в пределах 1—5 долларов. Отчасти и поэтому по итогам семи месяцев доля наших лекарств в стоимостном выражении составляет свыше 36 %. К концу 2015-го, рассчитывают в Минздраве, продажи на внутреннем рынке своих препаратов увеличатся до 50 %. Ускорить этот день можно, подняв цены на выпускаемые лекарства или ограничив импорт. Но ни то, ни другое для потребителя уж точно полезно не будет.
Комментарий в тему
Виктор ШЕИН, заместитель директора — начальник управления Департамента фармацевтической промышленности Минздрава:
— В стране работает 28 предприятий, имеющих лицензию на производство лекарственных средств. Из них шесть непосредственно находится в ведении нашего департамента. Суммарно на них приходится более 70 % производства в валовом объеме. Для выпуска лекарственной продукции в стране используется 1177 фармацевтических субстанций, из них 69 разработаны на наших фармпредприятиях и на предприятиях Академии наук.
Мария ДРУК
m_druk@mail.ru